Tonminerale
Eine wichtige Neubildung im Verlauf der Bodenentwicklung sind die Tonminerale. Dabei handelt es sich um schichtweise aufgebaute, plättchenartige Minerale. Sie sind überwiegend kleiner als 0,002 Millimeter und bilden den Hauptanteil der Mineralteilchen der Korngröße (= Bodenart) „Ton“ im Boden. Die Schichten der Tonminerale setzten sich aus einer Kombination von Silizium-, Sauerstoff-, Aluminium- und Wasserstoffatomen zusammen. Einige Tonminerale können Wasser und Nährstoffe speichern und abgeben. Sie sind somit für die Bodeneigenschaften und die Ernährung der Pflanzen äußerst wichtig.
Tonmineralarten
Nach ihrem Kristallaufbau unterscheidet man Zweischicht-, Dreischicht- und Vierschichttonminerale sowie Wechsellagerungsminerale und Allophane. Mit Ausnahme der Allophane zeichnen sich die Tonminerale durch einen typischen Aufbau ihrer Schichtpakete aus, der auch ihre jeweiligen Eigenschaften bestimmt. Die Abfolge mehrerer Schichten oder Silikatschichten bildet dabei einzelne Tonmineralplättchen.
Zweischichttonminerale
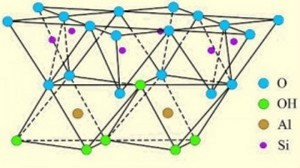
Die Schichten oder Silikatschichten der Zweischichttonminerale bestehen aus zwei aufeinander folgenden Ionen-Gittern (von griechisch ionos = Wanderer). In der einen Schicht sind nebeneinander immer vier Sauerstoff-Ionen um ein Silizium-Ion verteilt. Und zwar so, dass die Sauerstoff-Ionen, wenn man sie mit einer gedachten Linie verbindet, jeweils einen Tetraeder erzeugen (Tetraeder = von vier gleichseitigen Dreiecken begrenzter Körper). Daher heißt diese Schicht auch Tetraederschicht (= SiO4-Tetraeder). Die Tetraeder sind zur Seite hin durch jeweils ein gemeinsames Sauerstoff-Ion miteinander verbunden. Zweischichttonminerale bestehen aus einer Abfolge von einer Tetraeder- und einer Oktaederschicht. O = Sauerstoff-Ion, OH = Hydroxid-Ion, Al = Aluminium-Ion, Si = Silizium-Ion. In der zweiten Schicht sind nebeneinander jeweils um ein Aluminium-Ion sechs Sauerstoff-Ionen gruppiert. Wenn man hier wieder die entsprechenden gedachten „Gitterlinien“ zieht erhält man einen Oktaeder (Oktaeder = von acht Flächen begrenzter Körper). Deshalb heißt diese Schicht Oktaederschicht (= AlO6-Oktaeder). Beide Schichten haben einige gemeinsame Sauerstoff-Ionen. Die übrigen Sauerstoff-Ionen der Oktaeder sind mit Wasserstoff-Ionen (= Protonen) verbunden. Deshalb befinden sich an einigen Ecken der Oktaeder OH-Ionen, auch Hydroxid-Gruppen genannt. Einzelne Tonmineralplättchen werden von mehreren derartigen Doppel-Schichten übereinander aufgebaut. Bei Zweischichttonmineralen kommen daher die OH-Ionen mit den Sauerstoff-Ionen der nächsten Doppel-Schicht in Kontakt, wodurch stabile Wasserstoffbrückenbindungen entstehen. Zweischichttonminerale sind deswegen nicht oder kaum quellfähig. Das bekannteste Zweischichttonmineral ist der Kaolinit, benannt nach dem Berg Kaoling in der chinesischen Provinz Kiangsi, einem Abbauort von Porzellanerde. Nährstoffe können sich bei Zweischichtmineralen nur an den Außenflächen oder an Bruchflächen anlagern. Daher sind Böden, in denen Zweischichtminerale vorherrschen, nicht besonders fruchtbar. Diese Tonminerale entstehen vor allem bei intensiver Verwitterung wie zum Beispiel in den Tropen.
Dreischichttonminerale
Bei diesen Tonmineralien ist die Oktaederschicht von zwei Tetraederschichten umgeben. Dabei zeigen die „Spitzen“ der Tetraeder jeweils zur Oktaederschicht. Bei der Bildung der Dreischichttonminerale werden die zentralen Silizium und Aluminium-Ionen der Tetra- und Oktaederschichten oft durch andere, ähnlich große Ionen mit vergleichbarem Radius ersetzt. Silizium-Ion zum Beispiel durch ein Aluminium-Ion und das Aluminium-Ion wiederum durch ein Eisen- oder Mangan-Ion ersetzt werden. Dreischichttonminerale bestehen aus einer Abfolge von einer Tetraeder-, einer Oktaeder- und einer Tetraederschicht. O = Sauerstoff-Ion, OH = Hydroxid-Ion, Al = Aluminium-Ion, Si = Silizium-Ion, Fe = Eisen-Ion, Mn = Mangan-Ion). Si kann durch Al und Al durch Fe oder Mn ersetzt sein. Dadurch erhalten Dreischichttonminerale eine negative Ladung, die sie durch die Anlagerung von Kationen in ihre Zwischenschichten ausgleichen. Doch diese Ionen haben eine andere Wertigkeit. Die Folge ist eine negative Ladung der Dreier-Schichten. Zum Ladungsausgleich werden zwischen die Dreier-Schichten positiv geladene Kationen eingelagert: Na+, Mn2+ und andere, die bis auf einige Ausnahmen gut austauschbar sind. Auch Wasser kann zwischen den Schichten aufgenommen und auch wieder abgegeben werden, da relativ feste Wasserstoffbrückenbindungen fehlen und der Zusammenhalt der Dreier-Schichten weniger fest ist. Dreischichttonminerale können Nährstoff-Ionen und Wasser aufnehmen, speichern und wieder abgeben. Sie sind damit quellfähig oder aufweitbar. Neben dem Humus spielen sie deshalb eine herausragende Rolle für die Ernährung von Pflanzen. Die Nährstoff-Ionen wandern zwischen den Pflanzenwurzeln und den Bodenteilchen über das Wasser im Boden hin und her.
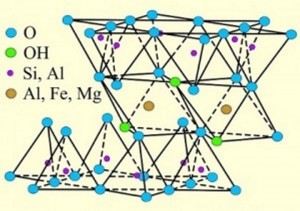
Dreischichttonminerale sind typisch für fruchtbare Böden. Das bekannteste Dreischichtmineral ist der Montmorillonit, benannt nach einer Lagerstätte bei der Stadt Montmorillon in Südfrankreich. Dreischichtminerale bilden sich bei nicht zu intensiver Verwitterung und Versauerung des Bodens. Sie sind daher in vielen Böden aus ehemals kalkhaltigen eiszeitlichen Ablagerungen enthalten (Löss). Weitere häufig im Boden vorkommende Dreischichtminerale sind Illit und Vermiculit. Der Name „Illit“ stammt aus dem Jahr 1937, in dem das Mineral erstmals im US-Bundesstaat Illinois beschrieben wurde. Der Name „Vermiculit“ (von lateinisch vermiculus, das Würmchen) beschreibt das Aussehen des Minerals.
Vierschichttonminerale
Vierschichtminerale gehören zu den nicht aufweitbaren Tonmineralen. Denn bei ihnen folgt nach eine Tetraeder-, Oktaeder- und Tetraederschicht noch eine Oktaederschicht. Hier stoßen OH-Ionen und Sauerstoff-Ionen der Vierer-Schichten wieder zusammen, was zu einem festen Zusammenhalt führt. Vierschichttonminerale sind daher den Zweischichttonmineralen recht ähnlich. Zu ihnen zählen die Chlorite (von griechisch „chloros“ = grün). Sie besitzen ähnlich schlechte Eigenschaften hinsichtlich des Austausches von Nährstoffen wie Kaolinit und entstehen in sauren Böden aus Dreischichtmineralien.
Wechsellagerungsminerale und Allophane
Häufig treten auch Mischungen der genannten Tonminerale beziehungsweise der beschriebenen Schichtfolgen auf, die Wechsellagerungsminerale oder Übergangsminerale genannt werden. Sie stellen Kombinationen der verschiedenen Tonminerale dar. Zum Beispiel Schichtpakete aus Illit und Montmorillonit. In jungen Böden aus Vulkanaschen finden sich als Tonmineralien häufig Allophane von griechisch „allos“ = anders und „phanos“ = erscheinen. Sie besitzen nicht das ausgeprägte Kristallgitter der anderen Tonminerale und gelten daher als Vorstufe zu diesen. Allophane sind amporh und entstehen z. B. aus Verwitterungsprodukten vulkanischer Gläser und Bims. So sind zahlreiche Böden in Mitteleuropa, die vom Fallout der Laacher See Eruption vor etwa 12.900 Jahren betroffen waren (z. B. Rheinisches Schiefergebirge), reich an Allophan. Auch in sauren Böden aus Granit entstehen Allophane bei kühl-feuchtem Klima. Wegen ihrer hohen Austauschkapazität für Ionen können Allophane zum Beispiel sehr gut Schadstoffe aus dem Sickerwasser aufnehmen. Ein Gramm Allophan hat eine Oberfläche von bis zu 800 Quatratmetern.
Entstehung
Tonminerale entstehen entweder durch Herauslösen von Ionen aus bestehenden Mineralien und den Ersatz dieser Ionen durch andere oder sie bilden sich ganz neu aus den Überresten der chemischen Verwitterung. Aus dem Mineral Glimmer, das schon blättchenartig aufgebaut ist, können beispielsweise Kalium-Ionen herausgelöst werden. Sie werden durch Wasserstoff-Ionen ersetzt und es entsteht das am Rande aufweitbare Tonmineral Illit. Bei Böden, die sich in tonreichen Ablagerungen bilden, sind Tonminerale schon Bestandteil des Sediments.
Beispiel: Verwitterung und Tonmineralbildung bei dem Mineral Kalifeldspat (Orthoklas) im Granit
Kalifeldspat ist Bestandteil des bekannten Gesteins Granit. Kommt dieses Gestein aus Quarz, Feldspat und Glimmer mit Wasser in Kontakt, reagieren die Kationen und Anionen des Wassers (H+ und OH-) mit dem Feldspat in folgender Weise:
2KAlSi3O8 + 2H+ + 2OH– -> 2HAlSi3O8 + 2KOH
Kalifeldspat + Wasserstoff + Hydroxyl -> Alumosilizische Säure + Kaliumhydroxid
Hierbei wird ein H+-Ion gegen ein Kation (Kalium-Ion) des Minerals ausgetauscht. Das Kalium-Ion wiederum verbindet sich mit dem OH- zu einem Hydroxid. Die entstandene alumosilizische Säure und das Kaliumhydroxid sind instabil und gehen somit weitere Reaktionen ein:
A) Kaliumhydroxid reagiert mit dem Niederschlagswasser, das eine schwache Säure, eine Kohlensäure ist, in folgender Weise:
2KOH + H2CO3 -> K2CO3 + 2H2O
Kaliumhydroxid + Kohlensäure -> Kaliumcarbonat + Wasser
Das Kaliumhydroxid wurde carbonatisiert. Es ist damit wasserlöslich und wird mit dem Sickerwasser weggeführt.
B) Die alumosilizische Säure reagiert mit dem übrigen Wasser folgendermaßen:
2HalSi3O8 + 9H2O -> Al2Si2O5(OH)4 + 4H4SiO4
Alumosilizische Säure + Wasser -> Kaolinit + Orthokieselsäure
Auch die entstandene Orthokieselsäure ist wasserlöslich und wird folglich mit dem Sickerwasser weggeführt. Als Restprodukt bleibt das Zweischichttonmineral Kaolinit. Auch der Glimmer des Granits unterliegt der chemischen Verwitterung. Da der Quarz recht unanfällig für Verwitterungsprozesse ist, bildet er schließlich die Hauptmasse des Verwitterungsschuttes. Ganzjährig hohe Temperaturen und hohe Feuchtigkeit fördern den Prozess dieser so genannten Silikatverwitterung, so dass sie insbesondere in den Tropen tiefgründige Verwitterungsdecken entstehen ließ.


 (46 Benutzer, Mittelwert: 4,85 Sterne von 5)
(46 Benutzer, Mittelwert: 4,85 Sterne von 5)