Stickstoffumsetzung

Stickstoff (N) ist ein wichtiger Baustein aller Lebewesen und als zweiatomiges Molekül (N2) Hauptbestandteil der Luft (rund 78 Vol.-%). Im Boden finden wesentliche Prozesse innerhalb des globalen Stickstoffkreislaufs statt.
Stickstoff gelangt durch verschiedene Prozesse in den Boden: Von Natur aus durch atmosphärische Deposition [mit der Luft (Bodenluft) in molekularer Form (N2)] und Tierdung (Wildtiere) sowie durch tierische und pflanzliche Rückstände (Kadaver, Bestandesabfall). Durch den Menschen gelangt Stickstoff in Form von organischen und anorganischen Düngern (z. B. Kompost, Klärschlamm, Gülle, Kunstdünger, Dung von Weidetieren) in den Boden.
Luftstickstoff kann von Pflanzen nicht unmittelbar verwertet werden. Sie können das stabile N2-Molekül nicht in eine andere Verbindung umwandeln. Pflanzen können zur Aminosäuren-Synthese Stickstoff nur in Form von Ammonium (NH4+) oder Nitrat (NO3–) verwenden. Die einzigen Lebewesen, die in der Lage sind, Luftstickstoff zu binden, das heißt elementaren Stickstoff (N2) in eine für Pflanzen verfügbare Form zu überführen, sind aerobe und anaerobe Bakterien. Sie verarbeiten mittels enzymatischer Prozesse elementaren Stickstoff (N2) zu Ammonium (NH4+). Tierische Ausscheidungen (Kot, Urin) und pflanzliche Rückstände und deren Stickstoffverbindungen werden von aeroben und anaeroben Bakterien sowie durch Pilze enzymatisch zersetzt. Urin (Gülle) wird durch das Enzym Urease zersetzt (Harnstoffspaltung), das u. a. in Böden verbreitet vorkommt. Dabei wird leicht flüchtiges Ammoniak gebildet. Es katalysiert beim Harnstoff folgender biochemischer Prozess:
(NH2)2CO + H2O → 2 NH3 + CO2
Das durch die Spaltung des Harnstoffs [(NH2)2CO] entstandene Ammoniak (NH3) geht entweder als Ammonium (NH4+) in Lösung oder entweicht in die Atmosphäre. Bakterien wie Nitrosomonas, Nitococcus und Nitrobacter sorgen im Boden für die bakterielle Oxidation von Ammonium zu NO3– (= Nitrifikation). Unter anaeroben Bedingungen (z. B. Staunässe) entstehen auch N2O (Distickstoffmonoxid oder Lachgas) sowie durch denitrifizierende, heterotrophe und autotrophe Bakterien (z. B. Paracoccus denitrificans) molekularer Stickstoff (N2) und Stickstoffoxide (Denitrifikanten), die in die Atmosphäre entweichen.
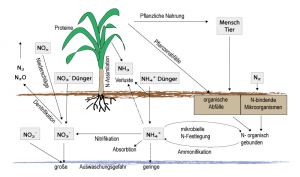
Da NO3–-Ionen negativ geladen sind, werden sie von den meist negativ geladenen Bodenkolloiden (Humus, Tonminerale) kaum sorbiert und daher schnell ausgewaschen. So können sie in das Grund- und somit in das Trinkwasser gelangen. Im Körper des Menschen wird Nitrat in Nitrit und in Nitrosamine umgewandelt, deren weitere Zerfallsprodukte derzeit von der medizinischen Fachwelt als kanzerogene Substanzen eingestuft werden. Bei Kahlschlägen und Kleinkahlschlägen (ca. 1 ha, für forstwirtschaftliche Zwecke, Standorte für Windindustrieanlagen) oder großflächigem Windwurf im Wald führt die stärkere Belichtung des Waldbodens zu einer vermehrten Aktivität des Edaphons mit der eine schnellere Mineralisierung der postmortalen organischen Substanz (Humus) einhergeht. Durch die Überschuss-Mineralisierung und die bakterielle Oxidation von NH4+ zu NO3− (Nitrifikation) erhöht sich die Gefahr einer Nitratauswaschung ins Grund- und somit in das Trinkwasser.
Meist holen sich die Pflanzen den benötigten Stickstoff in Form von Nitrat aus dem Boden. Doch bei Pflanzen aus der Familie der Schmetterlingsblütengewächse (Leguminosae) hat sich eine besondere Lebensgemeinschaft, eine Symbiose gebildet. Stickstoff bindende Bakterien der Gattung Rhizobium (= Eubakterien) leben in bestimmten Bereichen der Wurzel, den so genannten Wurzelknöllchen. Und zwar als so genannte Bakteroide ohne äußere Zellwand.
Diese Bakteroide besitzen Enzyme zur Fixsierung von Luft-Stickstoff (N2). Das wichtigste Enzym unter ihnen ist die Nitrogenase. Der Haken: Sie ist sehr empfindlich gegenüber Sauerstoff. Doch ganz ohne Sauerstoff können die Bacteroide auch nicht leben. Was nun? Die genau richtige Sauerstoffkonzentration – nicht zu viel, nicht zu wenig – übernimmt die Pflanze. Das macht sie, indem sie ein eisenhaltiges Protein in den Knöllchen bildet. Dieses so genannte Leghämoglobin bindet ein Zuviel an Sauerstoff und hält seine Konzentration konstant niedrig. Das Leghämoglobin ähnelt in seinem chemischen Aufbau dem gleichfalls Sauerstoff bindenden Hämoglobin unseres Blutes. Daher sind die Wurzelknöllchen ebenfalls rötlich.


 (8 Benutzer, Mittelwert: 4,63 Sterne von 5)
(8 Benutzer, Mittelwert: 4,63 Sterne von 5)
Schreibe einen Kommentar