Ionenaustausch
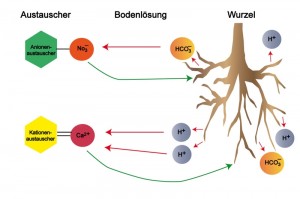
Eine für die Pflanzenernährung bedeutende Eigenschaft von Böden ist deren Fähigkeit, an ihren Festsubstanzen (mineralische und organische) Ionen, Moleküle, organische Stoffe (auch Schadstoffe) und Wasser reversibel (austauschbar) zu binden (Adsorption, Desorption), da die Oberflächen der Festsubstanzen elektrisch geladen sind. Für Pflanzen wichtige Nährstoff-Ionen wie beispielsweise Ca2+ (Calcium), Mg2+ (Magnesium) oder Na+ (Natrium) können dadurch an den Oberflächen der Festsubstanzen gebunden und wieder an die Bodenlösung abgegeben werden, indem andere Ionen diese ersetzen. Man spricht deshalb auch vom Ionenaustausch (siehe Grafik). Die elektrisch geladenen Festsubstanzen oder Bodenteilchen fungieren somit als Ionentauscher. Für die Pflanzen hat dies den großen Vorteil, dass Nährstoffe nicht sofort vom Sickerwasser aus dem Wurzelraum ausgewaschen, sondern in diesem aus der Bodenlösung mehr oder weniger kontinuierlich aufgenommen werden können.
Ionenaustauscher
Insbesondere mineralische und organische Bodenbestandteile < 2 µm (= Bodenkolloide) mit hoher spezifischer Oberfläche (innere und äußere) sind dazu in der Lage und tragen hauptsächlich zur Gesamtladung des Bodens bei. Dazu zählen vor allem Tonminerale, insbesondere aufweitbare Dreischichttonminerale (z. B. Illit, Montmorillonit), und Huminstoffe, in geringerem Umfang auch Oxide und Hydroxide. Man kann diese Festsubstanzen sozusagen als Reservoir oder Speicher für Pflanzennährstoffe (und auch für Schadstoffe) bezeichnen. Dazu zählen sowohl Kationen (positiv geladene Ionen) als auch Anionen (negativ geladene Ionen). Negativ geladene Austauscher werden als Kationentauscher und positiv geladene als Anionentauscher bezeichnet. Der Austausch von Ionen findet als Prozess zwischen der Bodenlösung und den Festsubstanzen statt.
Aufgrund ihres inneren Baus sind Tonmineralien (= Schichtsilikate) in der Regel negativ geladen. Lediglich seitliche Bruchflächen weisen eine variable Ladung auf. Der Grund: Das Grundgerüst der Silikate ist das SiO4-Tetraeder, bestehend aus einem zentralen Silizium-Ion und vier Sauerstoff-Ionen. Bei der Entstehung der Tonminerale kommt es jedoch häufig vor, dass das zentrale Silizium-Ion (Si4+) z. B. gegen ein Aluminium-Ion (Al3+) ersetzt wird (= isomorpher Ersatz), wodurch ein Ladungsdefizit entsteht (negative Ladung). Zum Ladungsausgleich werden reversibel Kationen (z. B. Na+, Ca2+) angelagert. Die negative Ladung ist unabhängig vom pH-Wert der Bodenlösung. Tone besitzen daher eine überwiegend permanente Ladung und sind somit Kationentauscher. Bei Huminstoffen sind die negativen Ladungen durch COOH- und phenolische OH-Gruppen bedingt, von denen mit steigendem pH-Wert Protonen (H+) abgespalten werden (Dissoziation). In extrem saurem Milieu (<pH 3) können die organischen Bodenkolloide infolge einer Protonenanlagerung zu Anionentauschern werden. Sie besitzen daher ebenso wie Oxide und Oxidhydroxide eine variable Ladung. Enthalten Böden einen hohen Anteil an aufweitbaren Tonmineralen und Huminstoffen und liegen die pH-Werte der Bodenlösung zwischen 3 und 8 (z. B. Böden der feuchten kühl-gemäßigten Klimazone), so spielt der Anionen-Austausch wegen der überwiegend negativen Ladungen der Austauscher keine bedeutende Rolle. Es überwiegt der Kationen-Austausch. Daher besteht z. B. die Gefahr der Nitratauswaschung (NO3–) in das Grundwasser bei übermäßiger Düngung (z. B. Gülle) oder bei einer Überschuss-Mineralisierung nach Kahlschlägen im Wald.
Austauschvorgang
Bei einem Ionenaustausch werden niederwertige Ionen von höherwertigen wegen der stärkeren Coulombkraft (elektrostatische Anziehungskräfte) vom Austauscher verdrängt: Al3+ verdrängt Ca2+ und Ca2+ verdrängt Na+. Beim Anionentausch verdrängt z. B. PO43- (Phosphat) SO42- (Sulfat). Bei gleicher Wertigkeit verdrängt das Ion mit der größeren molaren Masse (M) das Ion mit der niedrigeren. So verdrängt beispielsweise K+ (39 g/mol) Na+ (23 g/mol). Die austauschbaren Kationen sind von einer Hydrathülle umgeben. Unter gleichwertigen Kationen ist der Durchmesser der hydratisierten Ionen entscheidend (Ionengröße). Je dünner die Hydrathülle, umso besser ist die Anlagerung an den Austauscher: Mg2+ > Ca2+ und Na+ > K+. Diese Reihenfolgen bezeichnet man als Selektivität. Auch die Art der Kationenionenaustauscher (Tonminerale) spielt beim Austausch eine Rolle. So bevorzugt beispielsweise Montmorillonit Na+, K+, Kaolinit hingegen eher Mg2+ und Ca2+. Berücksichtigt man lediglich die Ioneneigenschaften, so ergibt sich hinsichtlich Eintauschstärke und Haftfestigkeit folgende Reihe: AI3+ > Ca2+ > Mg2+ > K+ > Na+.
Austauschkapazität
Die Summe aller austauschbaren Kationen eines Bodens ist die Kationenaustauschkapazität (KAK). Die Maßeinheit der KAK ist mmolc/kg (mmol = 0,001 mol, c = charge). Dabei wird zwischen der potentiellen Kationenaustauschkapazität (KAKpot) und der effektiven Kationenaustauschkapazität (KAKeff) unterschieden. Die KAKpot gibt die unter optimalen Bedingungen (pH 8,1 nach DIN ISO 13536) maximal erreichbare austauschbare Menge an Kationen eines Bodens an (maximale Anzahl möglicher freier Kationenbindungsplätze). Die KAKeff gibt die tatsächliche Anzahl freier Kationenbindungsplätze beim aktuellen pH-Wert eines Bodens wieder. Je höher der Anteil organischer Austauscher im Boden und je höher der pH-Wert des Bodens, desto größer ist die KAKeff. In sauren Böden (pH <7) ist die KAKeff stets geringer als die KAKpot, da H+-Ionen Austauscherplätze zum Nachteil von Kationen belegen. Das Verhältnis von basischen Kationen zum Gesamtanteil aller Kationen an den Austauschern wird als Basensättigung (BS) bezeichnet (in %). In carbonathaltigen Böden (z. B. Rendzina, Terra fusca) werden häufig Basensättigungen von nahezu 100% erreicht, was bedeutet, dass an der KAK fast ausschließlich Ca2+-, Mg2+-, K+– und Na+-Ionen beteiligt sind. Die Basensättigung ist ein Indikator für die Bodengüte. Bei einem Anteil basischer Kationen mehr als 70% liegt eine hohe Basensättigung vor, unter 35% eine geringe.


 (35 Benutzer, Mittelwert: 4,80 Sterne von 5)
(35 Benutzer, Mittelwert: 4,80 Sterne von 5)
Super zusammengefasst, ich habe sehr lange nach einer so guten Unterscheidung der effektiven und potentiellen KAK gesucht